1. 기체(Gas)가 하는 일
2. 기체(Gas)의 내부 에너지
3. 열역학 제 1법칙 - 에너지 보존의 법칙
이전 포스팅에서는
'열역학 제 0법칙(The zeroth law of thermodynamics) 열적 평형 상태'에 대해서
공부하고 정리해 봤어요.
열역학 법칙에는
제 0법칙, 1법칙, 2법칙, 3법칙, 4 법칙이 있는데요.
이번 포스팅에서는
'열역학 제 1법칙(The first law of thermodynamics)'
'에너지 보존 법칙'에 대해서 공부하고 정리해봤어요~
'열역학 제 1법칙'은
'하나의 고립계가 갖고 있는 에너지의 총량은 일정하다.'라는 법칙이에요.
외부와 에너지를 주고받지 않는 조건일 때,
계 내부의 에너지는 형태만 바뀔 뿐
사라지거나 생기지 않고 총량이 일정하다는 뜻이에요.
간단하게 말하면, 에너지가 보존된다는 이야기에요.
하나의 계와 외부 사이에 에너지 이동이 있다고 했을 때에도
에너지가 외부(또는 다른 계)로 10만큼 빠져나가면,
계 내부 에너지의 총량도 10만큼 감소해야 하고
에너지가 외부(또는 다른 계)로 10만큼 들어오면,
계 내부 에너지의 총량도 10만큼 증가해야 돼요.
이것이 에너지 보존 법칙(Law of conservation of energy)이에요.
여기서 '열(Heat)'과 '일(Work)'은 각각 하나의 에너지 형태로
계 내에서 Heat에서 Work로 변환 되거나,
반대로 Work에서 Heat로 변환이 가능해요.
그리고 '열역학 제 1법칙 - 에너지 보존의 법칙'은 아래와 같은 수식으로 나타낼 수 있어요.
"계의 '내부 에너지의 변화량(ΔU)'은
계의 외부에서 내부로 가해진 '열 에너지(Q)'와 계가 외부에 행한 '일 에너지(W)'의 차이와 같다" 라는 의미에요.
사람으로 생각해보면
음식을 먹어서 '열량(Q)'으로 에너지를 얻고, 몸을 움직여서 '일(W)'을 하면서 에너지를 쓰면
남는 에너지가 몸에 '내부 에너지(U)'로 남는 것과 같은 느낌이죠.
기체(Gas)에서 '에너지 보존 법칙'을 봤을 때
먼저 '기체가 하는 일(W)'과 '기체 내부 에너지(U)'에 대해서 알아볼 필요가 있을 것 같아요.
1. 기체(Gas)가 하는 일
-. 먼저 '일 에너지(W)'를 구하는 공식은 아래와 같아요.
'힘(F)' 곱하기 '거리(d)'를 하면 '일 에너지(W)'를 구할 수 있는데요.
어떤 사람이 물체에 일정한 힘(F)을 가해서 힘의 방향으로 일정 거리(d)만큼 움직였을 때
F x d 를 하면 사람이 물체에 행한 '일 에너지(W)'가 돼요.
그러면 기체(Gas) 분자가 한 일 에너지는 어떻게 구할까요?
기체(Gas)가 어떤 용기에 담겨 있는 상태에서
기체는 내부에서 용기에 '압력(P)'를 가하는데요.
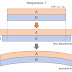
근데 만약 아래 그림처럼 기체(Gas)의 압력(P)에 의해서
기체가 담긴 용기가 'd 거리'만큼 팽창하고
용기의 부피가 변했다고 했을 때,
압력(P)는 힘(F) 나누기 면적(A)으로 나타낼 수 있고
부피 변화량(ΔV)는 면적(A) 곱하기 팽창한 거리(d)로 나타낼 수 있어요.
앞서 알아본 '일 에너지(W)'를 구하는 공식에 대입하면
기체(Gas)가 한 일 에너지를 구할 수 있어요.
'기체가 한 일(W)'은 '압력(P)' 곱하기 '부피 변화량(ΔV)'로 나타낼 수 있어요.
2. 기체의 내부 에너지
-. 열역학 법칙에서 다루는 '기체의 내부 에너지'는
'이상 기체(Ideal gas)'에서 분자나 원자의 '역학적 에너지'를 '열 역학적'으로 표현한 것이에요.
우선, 기체를 구성하는 분자나 원자는 끊임 없이 움직이고 있으며
각 입자는 '운동 에너지(Ek, Kinetic Energy)'를 갖고 있어요.
그리고 분자들 간에 '상호작용하는 힘'이 존재하며
그 힘에 의한 '위치 에너지(Ep, Potential Energy)'를 갖고 있어요.
따라서 '기체의 내부 에너지(U)'는 아래처럼 '운동 에너지(Ek)'와 '위치 에너지(Ep)'로 정의돼요.
그런데 '이상 기체(Ideal gas)'는 이론적으로만 존재하는 가상의 기체이며
다음과 같이 정리할 수 있어요.
1) 분자의 질량은 인정. But 부피(크기)는 무시.
2) 기체 분자 간의 상호작용(인력, 반발력) 무시. = 위치 에너지 무시.
3) 기체 분자 사이 혹은 벽과의 충돌은 완전탄성충돌. = 운동 에너지 총량 일정. 손실 없음.
이상 기체에서는 기체 분자 간의 상호작용을 무시하기 때문에
입자의 위치 에너지를 0으로 볼 수 있어요.
그러면 이상기체에서 '기체의 내부 에너지'는 '입자들의 운동 에너지의 합'과 같아요.
기체 분자의 운동, 압력의 관한 식과 이체기상 방정식으로 유도하면
기체의 내부 에너지(U)를 아래와 같은 식으로 나타낼 수 있어요.
(식을 유도하는 과정은 생략... 따로 정리해봐야겠어요 ㅋ)
n : 분자 수(mol수)
R : 기체 상수
T : 절대 온도 [K]
여기서 기체의 내부 에너지는 '절대 온도(T)'에 영향을 받는 걸 알 수 있어요.
온도가 증가하면 기체 분자 속도가 빨라지면서 내부 에너지도 커지고
반대로 온도가 감소하면 기체 분자가 느려지면서 내부 에너지도 작아져요.
3. 열역학 제 1법칙 - 에너지 보존의 법칙
-. '기체가 하는 일(W)'과 '기체의 내부 에너지(U)'에 대해 알아봤으니
이제 기체의 에너지 보존 법칙을 보죠.
'밀폐된 용기(계)'에 기체(Gas)가 있다고 했을 때
외부에서 '용기(계)'에 '열(Q)'을 가하면 온도가 상승한 만큼 '내부 에너지(U)'가 증가해요.
그런데 밀폐된 기체의 온도(T) 상승으로 압력(P)도 증가하다가
용기(계)가 팽창하게 되면 기체(Gas)가 외부에 한 일(W)이 돼요.
앞서 이야기한 열역학 제 1법칙 에너지 보존 법칙처럼
밀폐된 용기 안에서 '기체 내부 에너지의 변화량(ΔU)'은
외부에서 가한 '열 에너지(Q)'에서 기체가 외부로 한 '일 에너지(W)'를 뺀 양과 같아요.
쭉 정리해 보는데 힘드네요.....
다음에는 열역학 제 2법칙에 대해서 정리해 볼게요.
** 공부하면서 정리해봤는데 오류가 있으면 댓글로 알려주세요.









댓글 없음:
댓글 쓰기